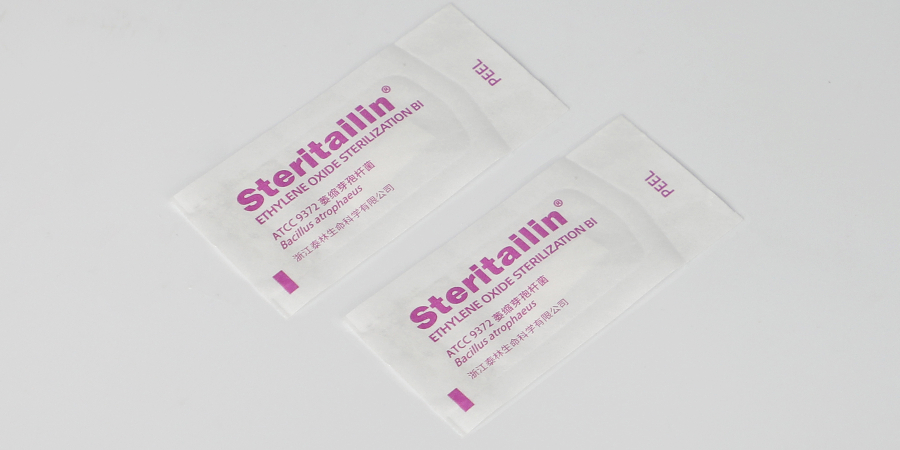
- 品牌
- 泰林生物
- 型號
- 載體型;芽孢懸液;自含式
- 尺寸
- 具體型號規格不一,請咨詢客服獲取更多信息
- 是否定制
- 否
生物指示劑殺滅實驗 實驗分組 陽性對照組:未滅菌的生物指示劑(驗證芽孢活性)。 陰性對照組:滅菌后未接種的培養液(排除污染)。 測試組:不同滅菌時間梯度(如2/4/6/8分鐘)測定D值。 生物指示劑殺滅實驗通過量化微生物滅活效果,為滅菌工藝驗證提供科學依據。實驗需嚴格遵循標準操作(如ISO 11138),控制關鍵變量(溫度、時間、芽孢負載),并結合數據計算D值/KT值。定期實驗可確保滅菌工藝的持續有效性,降低醫療感染風險。 實驗步驟(以壓力蒸汽滅菌為例) 裝載生物指示劑 將生物指示劑置于滅菌器最難滅菌位置(如器械管腔、裝載中心)。 每組至少3個重復,確保統計可靠性。 運行滅菌程序 設定121℃,分別處理2/4/6/8分鐘(用于D值計算)。 終止與回收 立即取出生物指示劑,冷卻至室溫。 自含式:直接按壓激活培養;懸液式:無菌轉移至培養液。 培養與觀察 嗜熱脂肪地芽孢桿菌:55-60℃培養48小時。 萎縮芽孢桿菌:30-37℃培養48小時。 結果判讀:培養基變黃(陽性)或渾濁(懸液式)表示滅菌失敗。醫用透析紙+Tyvek?雙包裝!阻菌率達99.9%,蒸汽/氣體穿透無憂。購買生物指示劑法規要求
環氧乙烷滅菌生物指示劑芽孢計數方法之芽孢洗脫后梯度稀釋和制備計數平皿 將該試管轉移至生物安全柜中,于旋渦混勻儀上旋渦30s,用移液槍吸取1mL芽孢懸液,加入到另一根含有9mL含0.1%聚山梨酯80的無菌純化水的試管中,記為10-2,按照該方法依次稀釋至10-3、10-4(稀釋級別按制造商提供的芽孢數量而定)。 取芽孢數在30cfu/mL-300cfu/mL的稀釋級別的試管(10-4)震蕩30s,每支稀釋管平行制備2個平皿,每皿加1mL菌懸液,注入15mL-20mL溫度不超過45℃融化的胰酪大豆胨瓊脂培養基(TSA)。等待瓊脂凝固后,倒置于30℃-35℃培養箱中培養48h-72h后計數。浙江生物安全柜生物指示劑實驗室液體滅菌監控:安瓿管式設計防破損,2-8℃冷鏈保存穩定。

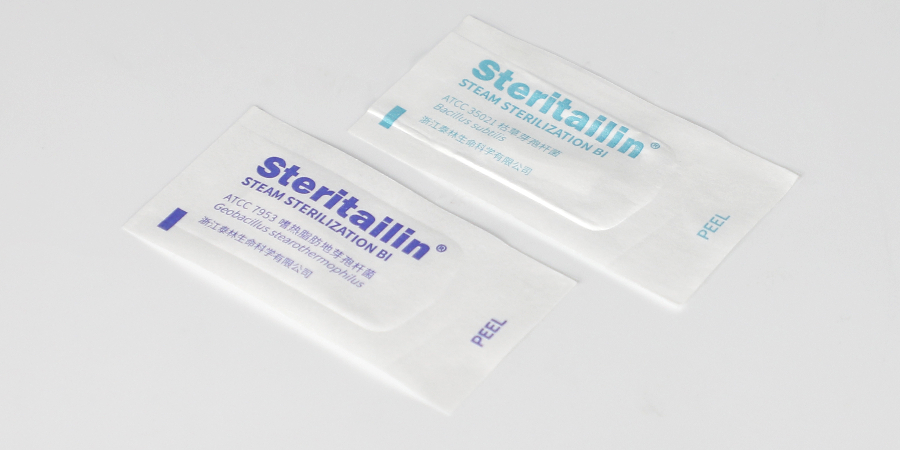
濕熱滅菌生物指示劑的選型 115℃,30min的滅菌程序,采用FBio值≥8min的指示劑是否合適? A:?生物指示劑F0值≥8min是指“121℃”下生物指示劑F0值。115℃,30min滅菌條件根據滅菌率(Z值=10℃)計算,115℃,30min滅菌條件相當于121℃滅菌7.5min,此時選用FBio值≥8min的生物指示劑,結果會有概率呈現陽性。該滅菌條件需選擇FBio值更低的生物指示劑,GB 18281.3-2015《醫療保健產品滅菌 生物指示物 第3部分:濕熱滅菌用生物指示物》指出在低于121℃的情況下,可以使用枯草芽孢桿菌(B.subtillis)ATCC 35021(5230)等菌種作為生物指示劑的指示微生物。
生物指示劑培養:操作指南、關鍵要點與常見問題解析 生物指示劑的培養是滅菌驗證的關鍵步驟,其結果直接反映滅菌工藝的有效性。 一、生物指示劑培養的基本原理 通過培養滅菌后的生物指示劑,檢測是否有微生物存活,從而驗證滅菌過程是否達到無菌保證水平(SAL 10??)。 關鍵機制: 滅菌后,若芽孢未被完全殺滅,殘留微生物在適宜條件下(溫度、營養)會復蘇生長,導致培養基變色(如溴甲酚紫變黃)。 若滅菌成功,芽孢全部死亡,培養基顏色不變(陰性結果)。泰林生物指示劑的自含式設計防止培養基蒸發,確保測試的準確性。
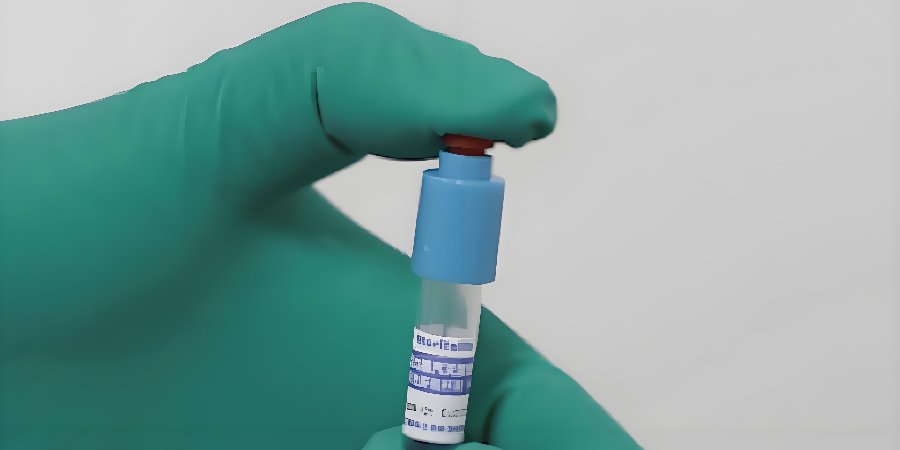
環氧乙烷滅菌生物指示劑芽孢計數注意事項 1、切勿將生物指示劑進行紫外照射消毒,建議對初級包裝進行擦拭。 2、環氧乙烷滅菌生物指示劑芽孢計數,建議使用含0.1%聚山梨酯80的無菌純化水進行稀釋。 3、吸取含紙質載體的菌液時,避免纖維堵槍頭,導致移液不準確。 4、建議以單片(支)生物指示劑的形式進行計數,確保每片(支)生物指示劑計數結果均符合要求。 5、建議使用玻璃珠(4mm-6mm)對紙質載體進行打散處理。 6、芽孢計數過程中必須進行熱激活處理:溫度80℃-85℃,時間10min。5大滅菌方式全覆蓋!真正的一站式滅菌驗證解決方案。浙江生物安全柜生物指示劑
泰林生物指示劑的D值穩定,確保在不同滅菌條件下的一致性。購買生物指示劑法規要求
過氧化氫滅菌生物指示劑的質量波動控制 過氧化氫滅菌驗證過程中,滅菌過程無異常,但是個別點位的生物指示劑呈陽性,是什么原因造成的呢? 美國注射劑協會(Parenteral Drug Association,PDA)第51號技術報告《氣體和汽相除污工藝生物指示劑:質量標準、生產、控制和使用》[將由于生物指示劑質量波動或其他未知因素導致難以殺滅的指示劑稱為"Rogue Bls”,即“流氓生物指示劑”。制造商可以通過提高工藝水平來避免這一現象的發生。下面主要針對初級包裝、載體、芽孢分布等因素對生物指示劑質量波動的影響,進行“流氓生物指示劑“成因和控制的分析。購買生物指示劑法規要求
- 采購生物指示劑芽孢數量 2025-07-03
- 西北生物指示劑載體 2025-07-03
- 環氧乙烷滅菌生物指示劑系列 2025-07-03
- 氣體用生物指示劑激活 2025-07-03
- 河南進口生物指示劑 2025-07-03
- 河北生物指示劑培養時間 2025-07-02
- TAILIN 生物指示劑質量控制 2025-07-02
- 過氧化氫低溫等離子滅菌生物指示劑培養 2025-07-02
- 重慶生物指示劑ISO標準 2025-07-02
- TAILIN 生物指示劑參數 2025-07-02
- 西北固體用生物指示劑 2025-07-02
- 過氧化氫低溫等離子滅菌生物指示劑質量控制 2025-07-02